Thérapie cellulaire
Guérir le diabète de type 1 (DT1) est l’objectif principal de Percée DT1 et d’un grand nombre de personnes parmi les 300 000 Canadiennes et Canadiens atteints de cette maladie et leur famille. La thérapie cellulaire est l’une des voies de recherche les plus actives et les plus rapides dans ce domaine, mais de quoi s’agit-il et dans quelle mesure ces approches sont-elles sur le point de devenir une réalité?
Dans le cadre de la stratégie de recherche mondiale de Percée DT1, la thérapie cellulaire fait généralement référence au remplacement (transplantation) de cellules productrices d’insuline qui réagissent au glucose et sont détruites chez une personne atteinte de DT1.
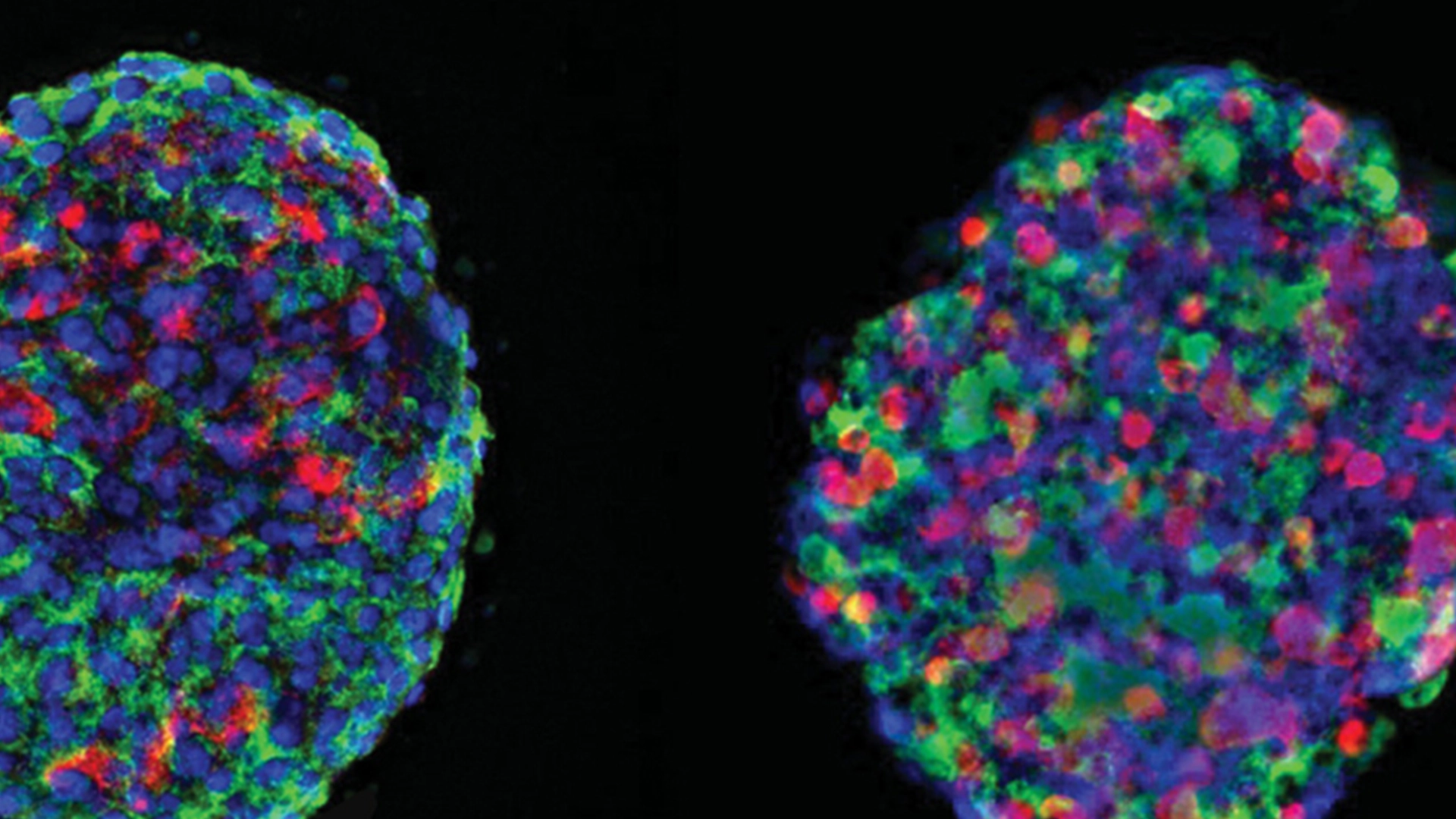
Les îlots pancréatiques sont des amas de cellules dans le pancréas qui sécrètent les hormones permettant le contrôle du taux de glucose dans le sang. Elles sont principalement constituées de cellules bêta, lesquelles détectent les taux de glucose et sécrètent de l’insuline en conséquence (hormone hypoglycémiante). Les cellules alpha, delta et gamma se retrouvent aussi dans les îlots pancréatiques. Ces types de cellules aident également au contrôle du glucose dans le sang en sécrétant des hormones, dont le glucagon (hormone hyperglycémiante) et l’amyline.
Depuis 1999, la thérapie de remplacement des îlots pancréatiques est devenue plus accessible au Canada grâce au développement d’une approche du Dr James Shapiro et de son équipe de l’Université de l’Alberta portant le nom de « Protocole d’Edmonton ». Le protocole d’Edmonton consiste à infuser des îlots pancréatiques, isolés du pancréas d’un donneur d’organes décédé, dans le foie d’une personne atteinte de DT1. Près de 300 personnes au Canada et de nombreuses autres dans le monde ont subi une transplantation d’îlots pancréatiques dans le cadre d’études de recherche et de procédures cliniques. Mais la plupart des personnes ne considèrent pas qu’il s’agisse d’une guérison du DT1, et ce pour de nombreuses raisons. Plus particulièrement, les résultats obtenus au Canada montrent que seuls 32 % des personnes étaient encore indépendantes de l’insuline cinq ans après une greffe d’îlots pancréatiques [1].
Les principaux défis de la thérapie traditionnelle de remplacement des îlots pancréatiques sont la nécessité de prendre des immunodépresseurs pour le reste de la vie, lesquels entraînent des effets secondaires et des risques, et de procéder à de multiples perfusions d’îlots pancréatiques au fil du temps en raison de la faible longévité des cellules. D’un point de vue logistique, il existe un autre obstacle de taille : la rareté des îlots pancréatiques requis pour la greffe. Deux à trois pancréas sont généralement requis pour extraire suffisamment de cellules pour une seule greffe, et de nombreuses personnes ont besoin d’îlots pancréatiques supplémentaires de donneurs lorsque la fonction de la greffe initiale commence à se détériorer. Il n’y aura jamais assez de cellules pour guérir le DT1 au Canada avec des îlots pancréatiques de donneurs. Le domaine a donc été confronté au défi de trouver une source illimitée ou renouvelable de cellules pour combler cette lacune. L’arrivée des cellules souches représente une potentielle solution très prometteuse à ce problème.
Les cellules souches ont été découvertes au Canada par James Till et Ernest McCulloch en 1961. Ces cellules sont particulières en raison de ce qu’on appelle la pluripotence, soit la capacité d’une cellule à se transformer en n’importe quel autre type de cellule dans le corps si les bons signaux sont fournis. Cette découverte a donné lieu à une croissance exponentielle du domaine de la médecine régénérative. En ce qui concerne le diabète, la recherche a commencé au début des années 2000 à explorer la possibilité de créer des cellules d’îlots pancréatiques ou des cellules bêta à partir de cellules souches et, en 2014, deux laboratoires, séparément, mais simultanément, ont « déchiffré le code ». À l’automne 2014, le Dr Doug Melton (Harvard) et le Dr Tim Kieffer (Université de Colombie-Britannique) ont tous deux publié leurs travaux montrant que des cellules bêta productrices d’insuline pouvaient être générées en laboratoire à partir de cellules souches humaines. Les travaux de ces deux groupes ont largement ouvert la voie aux essais cliniques actuellement menés par Vertex et ViaCyte (dont Vertex a récemment fait l’acquisition).
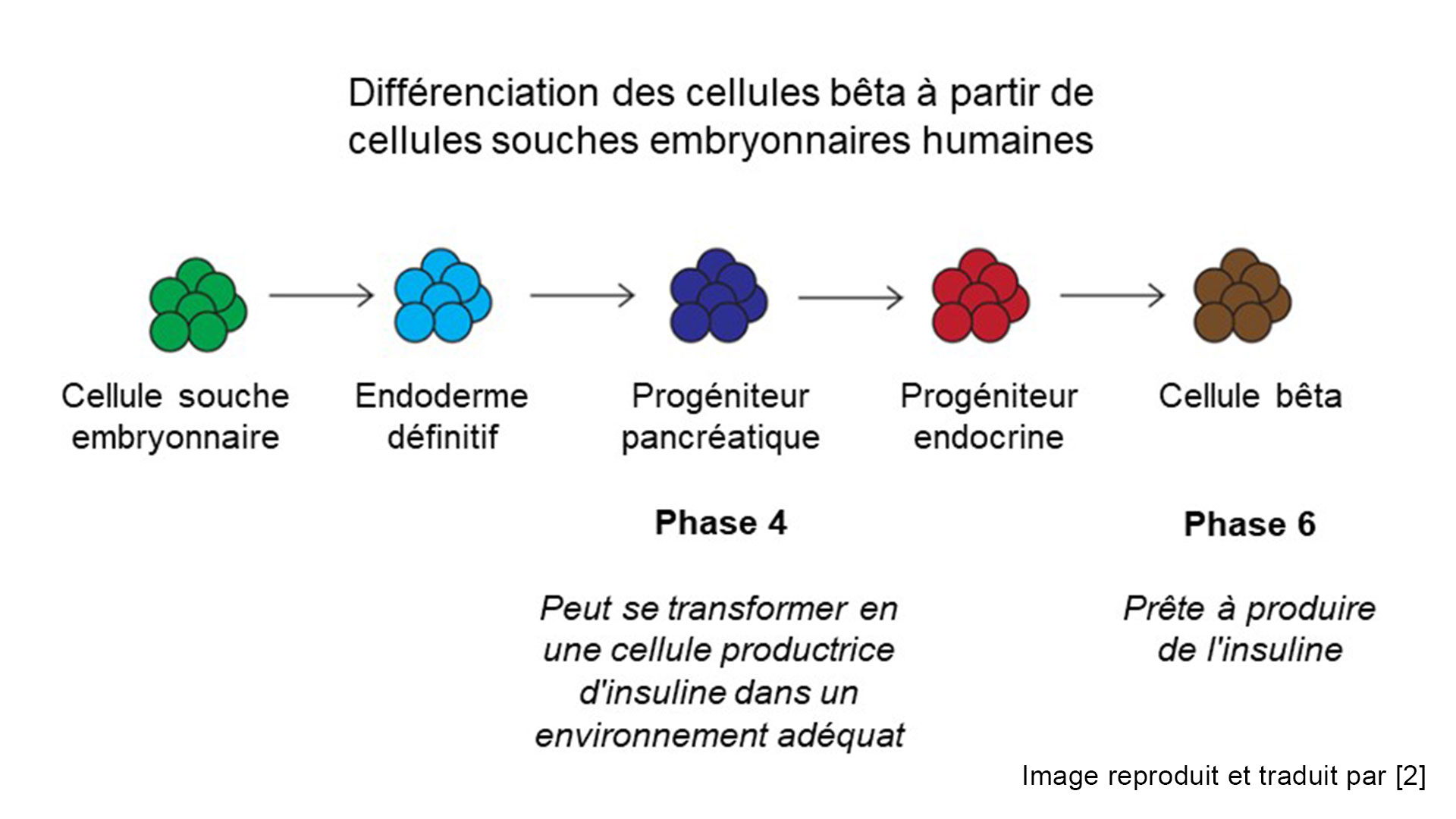
La recherche sur les sources cellulaires est toujours en cours, mais l’optimisation de la « recette » de la différenciation cellulaire a bénéficié d’années d’investissement dans la recherche. La plupart des recherches se sont concentrées sur la création de produits d’îlots à partir de cellules allogéniques (c’est-à-dire que la source cellulaire est obtenue à partir d’une personne différente de celle qui recevra le traitement), ce qui peut permettre d’obtenir une source évolutive de cellules bêta qui serait utilisée pour traiter de nombreux individus. Cependant, il est également possible de « reprogrammer » les propres cellules (autologues) d’une personne pour qu’elles redeviennent des cellules souches qui peuvent ensuite se différencier en cellules bêta.
En septembre 2024, des chercheurs chinois ont rapporté la première transplantation de cellules bêta créées à partir des propres cellules d’une personne (dans ce cas, du tissu adipeux a été utilisé) chez une femme de vingt-cinq ans qui recevait déjà des immunosuppresseurs pour une greffe de foie. Les cellules autologues peuvent éviter ou réduire la nécessité d’une immunosuppression pour réduire le risque de rejet du greffon, puisqu’elles ne proviennent pas d’un autre donneur. Cependant, on ne sait pas si l’immunosuppression serait encore nécessaire pour prévenir les attaques auto-immunes récurrentes associées au DT1. Percée DT1 investit dans cette approche par l’entremise d’une subvention de recherche accordée au Dr James Shapiro à l’université de l’Alberta pour aborder ces questions importantes sur le plan scientifique. Cependant, la stratégie de recherche mondiale de Percée DT1 dans le domaine des thérapies cellulaires est axée sur les cellules allogéniques (c’est-à-dire dérivées des cellules d’une autre personne) afin de créer des produits d’îlots pouvant être utilisés pour traiter un grand nombre de personnes atteintes de DT1, plutôt que de poursuivre des thérapies personnalisées. L’objectif ultime serait de pouvoir les utiliser sans avoir recours à l’immunosuppression.
RÉFÉRENCES
- Marfil-Garza, B. A., Imes, S., Verhoeff, K., Hefler, J., Lam, A., Dajani, K., … & Shapiro, A. J. (2022). Pancreatic islet transplantation in type 1 diabetes: 20-year experience from a single-centre cohort in Canada. The lancet Diabetes & endocrinology, 10(7), 519-532.
- Photiadis, Sara J.; Gologorsky, Rebecca C.; Sarode, Deepika. (2021) The Current Status of Bioartificial Pancreas Devices. ASAIO Journal 67(4), 370-381. 10.1097/MAT.0000000000001252
Au cours de la dernière décennie, Percée DT1 a investi plus de 140 millions de dollars américains à l’échelle internationale pour faire progresser les thérapies cellulaires vers la clinique. Malgré d’immenses progrès, il reste d’importants défis scientifiques à relever dans le cadre des travaux financés par Percée DT1.
Mise à l’échelle et fabrication : actuellement, la différenciation des cellules souches en îlots pancréatiques ne se produit qu’en très petites quantités. Ce processus devra être considérablement élargi et automatisé pour que la thérapie cellulaire soit rentable et accessible à un grand nombre de personnes.
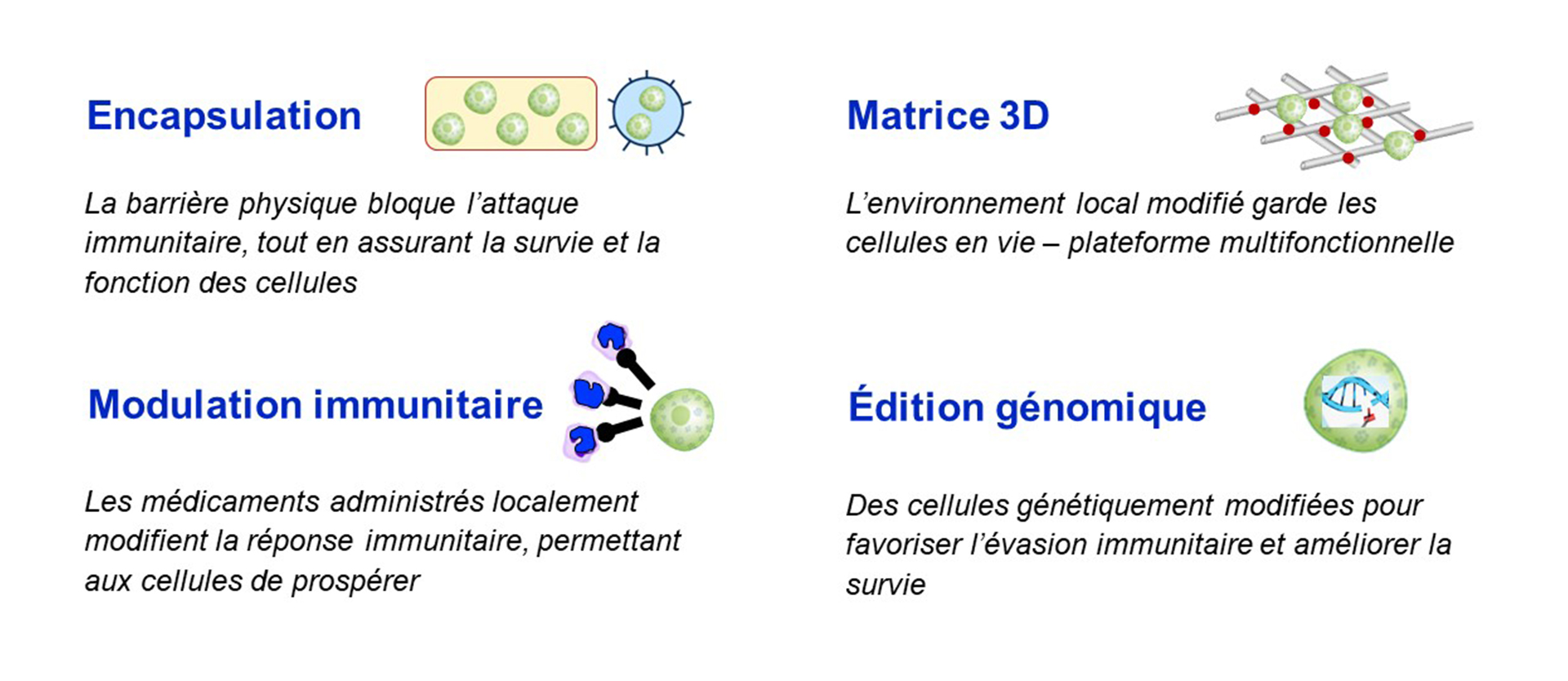
Protection immunitaire : l’obstacle le plus important à la thérapie cellulaire est la réponse immunitaire, et il comporte deux volets, car non seulement le corps humain est programmé pour rejeter les substances étrangères, mais les personnes atteintes de DT1 sont également programmées pour attaquer directement les cellules bêta. Quelques options sont actuellement explorées pour éviter la nécessité d’une immunosuppression pour le corps en entier (systémique) dans le cadre d’une thérapie de remplacement des îlots pancréatiques :
-
- La modulation immunitaire cible directement le système immunitaire. Il peut s’agir d’une immunosuppression locale qui modifiera la réponse immunitaire uniquement pour les cellules bêta, ou de « reprogrammer » le système immunitaire pour qu’il apprenne à ne pas attaquer les cellules transplantées.
- L’édition génomique des cellules souches utilisées pour fabriquer des îlots de remplacement est également explorée dans le cadre d’une approche de protection ou d’évasion immunitaire. Cela peut se faire en modifiant les gènes qui codent pour les protéines sur la surface des cellules qui sont détectées par le système immunitaire, compliquant ainsi la tâche pour le système immunitaire de détecter et d’attaquer les cellules transplantées.
- L’encapsulation fait référence à une barrière physique composée de biomatériaux pour protéger les cellules transplantées. La macroencapsulation (une barrière autour de toutes les cellules, semblable à un sachet de thé) ou la microencapsulation (une barrière autour d’îlots pancréatiques individuels) peuvent être réalisées à partir de matériaux immunoprotecteurs qui pourraient physiquement empêcher la détection et l’attaque du système immunitaire contre les cellules. L’un des défis de l’encapsulation est de permettre aux cellules de survivre (l’oxygène et les nutriments doivent pénétrer dans le dispositif) et de fonctionner (le glucose doit pénétrer dans le dispositif et l’insuline doit en sortir) avec le dispositif ou le revêtement protecteur qui les entoure.
Récupération des cellules transplantées : L’extraction des cellules est pratiquement impossible avec la perfusion d’îlots pancréatiques dans la veine porte du foie. La raison pour laquelle cela est important est que même lorsque les cellules souches ont été converties en îlots pancréatiques, cela ne signifie pas qu’elles ne se transformeront plus jamais. Toute cellule (mais surtout avec une cellule provenant d’une cellule souche) présente un faible risque de devenir un autre type de cellule, y compris une cellule cancéreuse. C’est l’un des arguments en faveur de la macroencapsulation à l’intérieur d’un « dispositif » (comme des feuilles de thé dans un sachet), car cela permettrait de récupérer le(s) groupe(s) entier(s) de cellules en cas de problème.
Améliorer la survie et la prise du greffon: la survie des cellules étrangères dans l’organisme nécessite un apport sanguin immédiat pour que les cellules reçoivent des nutriments vitaux. La greffe est réussie lorsque les cellules survivent à la transplantation et commencent à fonctionner comme prévu (dans ce cas, produire de l’insuline en réponse au glucose). Une étape importante est la vascularisation du greffon, c’est-à-dire son raccordement avec les vaisseaux sanguins. Actuellement, les taux de survie immédiate et de la prise du greffon sont assez faibles, ce qui explique que les greffes d’îlots pancréatiques doivent être répétées au fil des ans pour ajouter de nouvelles cellules afin de remplacer les cellules de la greffe précédente qui n’ont pas survécu. Les stratégies explorées pour améliorer la survie et la prise du greffon comprennent les matrices 3D biologiques, l’édition génomique pour surexprimer les gènes favorables à la survie, ou le traitement des cellules ou des receveurs de greffe avec des médicaments pour stimuler leur survie et la prise du greffon.
Emplacement de la transplantation : la pratique clinique actuelle pour la transplantation d’îlots pancréatiques prélevés sur un donneur consiste à perfuser les îlots pancréatiques dans la veine porte du foie. Étonnamment, le pancréas n’est pas un environnement très accueillant pour héberger les cellules des îlots pancréatiques, et n’est donc pas une solution optimale pour la survie des cellules. La macroencapsulation (ou les dispositifs) a été utilisée pour l’implantation dans l’espace sous-cutané de la peau, généralement sur le bras et/ou l’abdomen. Cet emplacement au niveau de la surface permet une récupération très facile, mais est moins optimal pour apporter des nutriments nécessaires aux cellules par la circulation sanguine. D’autres avenues sont explorées, notamment l’omentum – une grande couche de tissu adipeux qui tapisse la surface des organes abdominaux – et les muscles. Des recherches supplémentaires sont nécessaires afin d’établir un emplacement idéal pour le fonctionnement des cellules à long terme.
Comment faire passer ces thérapies cellulaires du laboratoire à l’utilisation clinique? Comme pour toute nouvelle thérapie, les essais cliniques sont l’étape cruciale pour faire passer la recherche du laboratoire au chevet du patient. Dans le cas des thérapies à base de cellules souches, des essais cliniques sont actuellement menés par des entreprises. Cependant, une grande partie de la recherche, du développement et de l’optimisation de ces thérapies se fait dans le cadre de la recherche universitaire, avec une participation grandissante des universités et de l’industrie.
ViaCyte a été la première entreprise à mener un essai clinique sur une thérapie à base de cellules souches pour les personnes atteintes de DT1 avec ses cellules souches VC-01 encapsulées provenant de cellules souches dans un dispositif (c’est-à-dire une pochette qui contient les cellules) en 2014. Malheureusement, les premiers essais cliniques ont révélé d’importantes limites du dispositif lui-même. Bien que des itérations ultérieures (VC-02) aient démontré que les participants produisaient du peptide C (un marqueur indiquant que l’insuline est fabriquée dans l’organisme), ce résultat n’était pas suffisamment significatif pour réduire le besoin de sources externes d’insuline. En 2022, Vertex a fait l’acquisition de ViaCyte, qui mène toutefois encore des activités en quelque sorte comme une entité distincte au sein de Vertex, en particulier parce que les essais cliniques de ViaCyte utilisent des cellules différentes de celles des produits de Vertex. ViaCyte, en partenariat avec CRISPR Therapeutics, est également la première entreprise à tester des cellules génétiquement modifiées (par la technologie d’édition CRISPR/Cas9) pour le remplacement des îlots pancréatiques. Les produits testés dans ces essais cliniques (VCTX210 et VCTX211) ont été modifiés pour échapper à la réponse immunitaire et font l’objet de tests d’innocuité, de tolérance et d’évasion immunitaire chez des patients atteints de DT1. Cette approche particulière (c’est-à-dire des îlots pancréatiques provenant de cellules souches génétiquement modifiées ne nécessitant pas d’immunosuppression) est considérée par plusieurs comme le « but ultime » de la thérapie cellulaire.
Vertex Pharmaceuticals est particulièrement active dans le domaine de la thérapie cellulaire pour le DT1 et mène deux essais cliniques internationaux (VX-880 et VX-264) depuis le printemps 2024 pour les personnes atteintes de DT1, sans compter les essais cliniques de ViaCyte en cours. Vertex a effectué de nombreux et importants investissements dans la thérapie cellulaire, notamment une collaboration en 2023 avec Lonza (une entreprise de biofabrication) pour construire une installation de fabrication consacrée à cet effet aux États-Unis, et une collaboration en 2024 avec TreeFrog Therapeutics pour l’obtention d’une licence sur la plateforme technologique exclusive C-Stem™ de TreeFrog pour la fabrication de cellules à grande échelle.
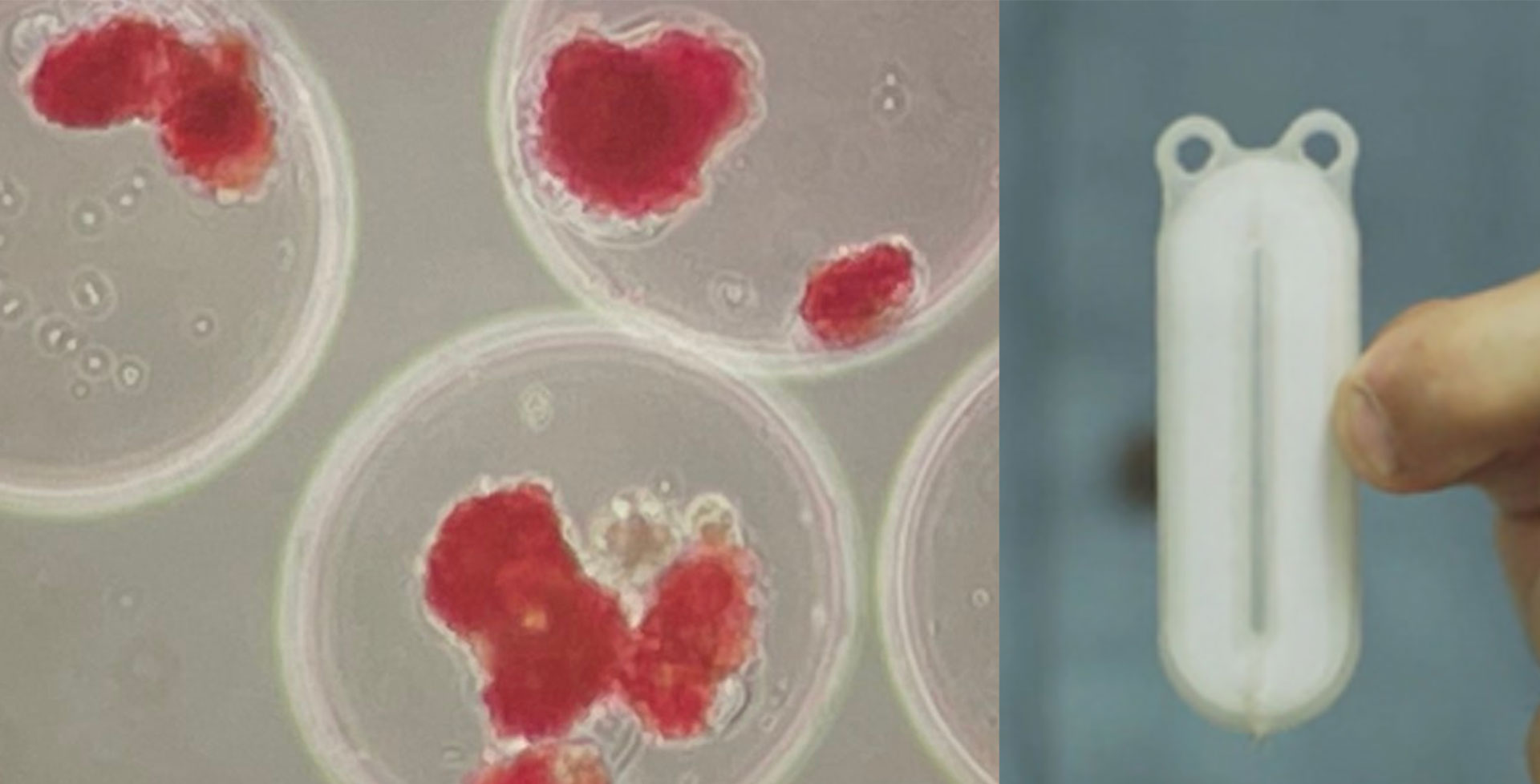
Parmi d’autres entreprises importantes dans ce domaine, figure Sernova (située à London, Ontario) qui teste son système Cell Pouch™ – un « dispositif » médical implantable qui héberge des îlots pancréatiques (voir l’explication sur la macroencapsulation plus haut). À ce jour, les rapports sont positifs et indiquent que les cellules dans le dispositif survivent et produisent de l’insuline. Toutefois, il est important de noter que tous les essais cliniques sur le dispositif Sernova ont jusqu’à présent été réalisés avec des îlots pancréatiques de donneurs décédés, et non avec des cellules souches. Les essais cliniques en cours sont menés à Chicago, Illinois. En 2022, Sernova et Evotec ont conclu un partenariat exclusif pour combiner le Cell Pouch de Sernova avec les cellules bêta provenant de cellules souches d’Evotec. Sernova collabore également avec la Dre Alice Tomei (Université de Miami) pour mettre au point une microencapsulation (revêtement d’îlots pancréatiques individuels) avec une technologie de protection immunitaire.
Plusieurs autres entreprises en sont à un stade de développement préclinique, trop nombreuses pour être toutes citées. Au Canada, Aspect Biosystems (située à Vancouver, Colombie-Britannique) a déjà été financée par Percée DT1 pour le développement d’un dispositif de macroencapsulation imprimé en 3D qui utilise des matériaux immunoprotecteurs. Novo Nordisk a fait l’acquisition d’Aspect Biosystems en 2023 pour poursuivre le développement de ce produit qui sera utilisé conjointement avec les îlots pancréatiques de remplacement développées par Novo Nordisk. Aucun essai clinique n’est en cours, mais nous suivrons ce partenariat de près. Allarta Life Sciences (située à Hamilton, Ontario) a reçu une subvention du Partenariat de découverte et de développement de l’industrie de Percée DT1 en 2023 pour faire avancer sa recherche sur les polymères et les hydrogels (un matériau similaire à celui utilisé pour les lentilles de contact) qui peuvent fournir un revêtement immunoprotecteur aux îlots pancréatiques.
Voici une liste abrégée d’autres entreprises dans le monde qui en sont à des stades précliniques de développement de thérapies cellulaires pour le DT1 (cette liste n’est pas exhaustive et les informations sont à jour au moment de la rédaction du présent document) :
- Eli Lilly a conclu un partenariat avec Sigilon Therapeutics en 2018 et a ensuite fait l’acquisition de Sigilon en 2023 pour faire progresser la recherche sur les thérapies cellulaires encapsulées.
- Novo Nordisk a conclu des partenariats avec plusieurs entreprises (dont Aspect Biosystems) pour faire progresser son produit de thérapie cellulaire.
- Sana Biotechnology, qui a rapporté au début de 2024 que ses îlots pancréatiques provenant de cellules souches génétiquement modifiées ont permis de contrôler efficacement le glucose dans le sang d’un primate atteint de diabète. Les essais cliniques sur des sujets humains sont prévus vers la fin de l’année 2024, et nous suivrons cette entreprise de près.
- Eledon Pharmaceuticals mène des essais cliniques à Chicago, Illinois, pour l’utilisation de son médicament tegoprubart en combinaison avec la transplantation d’îlots pancréatiques provenant de donneurs décédés afin d’éviter le rejet.
- Adocia prépare un premier essai clinique avec des sujets humains prévu à la fin de 2024 ou début de 2025 pour ses îlots AdoShell®, une matrice implantable et entièrement récupérable pour la transplantation d’îlots pancréatiques qui élimine le besoin de médicaments immunosuppresseurs.
- Betalin Therapeutics se concentre sur le développement d’un « micro pancréas » en utilisant une matrice constituée de tissus pulmonaires.
- iTolerance Inc. s’est associée à Kadimastem pour combiner des technologies immunomodulatrices avec des îlots pancréatiques.
Enfin, il y a la présence, petite, mais puissante, d’essais cliniques menés par des universitaires dans ce domaine. Plus particulièrement, le Dr James Shapiro (Université de l’Alberta et pionnier du Protocole d’Edmonton) maintient un programme de recherche actif massivement financé par Percée DT1, tout en étant chef chirurgien du programme de transplantation de cellules d’îlots pancréatiques le plus actif au monde. Le Dr Shapiro étudie divers moyens de réduire la nécessité d’une immunosuppression dans le cadre du Protocole d’Edmonton actuel et travaille au développement d’une source renouvelable d’îlots pancréatiques en utilisant les cellules actuelles d’une personne. Cette dernière approche n’est pas encore rendue au stade d’essai clinique, mais aura pour objectif de reprogrammer les cellules sanguines d’une personne en cellules souches avant de les différencier en îlots pancréatiques adaptées pour la transplantation sans immunosuppression.
Tableau des thérapies cellulaires au stade du développement clinique au Canada
| Source des cellules | Protection des cellules | Emplacement des cellules | Disponibilité/ emplacement |
|
|---|---|---|---|---|
| PRATIQUE CLINIQUE | ||||
| Transplantation d’îlots pancréatiques par l’entremise du Protocole d’Edmonton *thérapie clinique approuvée au Canada | Cellules de donneurs | Immunosuppression systémique | Perfusion dans la veine porte du foie | En pratique dans le monde entier depuis 2000 (*les États-Unis viennent d’autoriser Lantidra à utiliser ce protocole en dehors du cadre de la recherche). |
| ESSAIS CLINIQUES | ||||
| CRISPR VCTX210 (partenariat précédent avec ViaCyte) | Cellules souches | Édition génomique | Macroencapsulation (dispositif) | Essais cliniques terminés dont les résultats ou les informations n’ont pas été publiés. |
| CRISPR CTX211 (partenariat précédent avec ViaCyte) | Cellules souches | Édition génomique (éditions supplémentaires de VCTX210) | Macroencapsulation (dispositif) | Essais cliniques en cours au Canada (Vancouver, Edmonton) |
| Vertex VX-880 | Cellules souches | Immunosuppression systémique | Perfusion dans la veine porte du foie | Essais cliniques en cours dans le monde entier (Canada : Vancouver, Edmonton, Toronto) |
| Thérapie de remplacement cellulaire encapsulée de Encellin (EnCRT) | Cellules de donneurs | Macroencapsulation | Macroencapsulation(dispositif) | Essais cliniques en cours au Canada (Montréal) |
| Université de l’Alberta (Dr Shapiro) – Technique sans dispositif | Cellules de donneurs | Immunosuppression systémique | Implantation sans dispositif sous la peau | Essais cliniques en cours au Canada (Edmonton) |
| Université de l’Alberta (Dr Shapiro) – PKX-001 | Cellules de donneurs | Immunosuppression réduite par l’entremise de la modulation de l’immunité cellulaire | Perfusion dans la veine porte du foie | Essais cliniques en cours au Canada (Edmonton) |
-
1980
Des chercheurs et des cliniciens procèdent à une transplantation d’îlots pancréatiques avec succès chez 10 personnes ayant développé un diabète après l’ablation de leur pancréas malade (pancréatite), réinjectant les îlots pancréatiques saines de ces mêmes personnes après les avoir isolées. Trois de ces personnes sont devenues insulino-indépendantes pendant 1, 9 et 38 mois, respectivement. 1
-
1987
Un anticorps monoclonal qui reconnaît un type de cellule spécifique du système immunitaire est utilisé pour transplanter d’îlots pancréatiques productrices d’insuline chez des souris, sans recourir à l’utilisation continue de médicaments immunosuppresseurs potentiellement nocifs.2 Il est démontré que le rejet est évité indéfiniment chez les modèles animaux.
-
1990
Deux études pionnières sur la transplantation d’îlots pancréatiques chez les personnes atteintes de diabète sont menées sur un total de 10 personnes aux États-Unis. Les patients sont devenus insulino-indépendants pendant quelques semaines ou le besoin en insuline fut minimal. Il s’agit des premiers exemples convaincants de la réussite d’une transplantation clinique d’îlots pancréatiques.3,4
-
1994
Les premiers essais cliniques sur des sujets humains pour la transplantation d’îlots pancréatiques de porcs ont été réalisés auprès de personnes atteintes de diabète de type 1 et d’insuffisance rénale. Ces études furent remarquables, car la production d’insuline par les îlots pancréatiques a été détectée pendant plus de 300 jours dans de nombreux cas, et aucun effet secondaire grave n’a été observé. Aucune réduction des besoins en insuline ni une indépendance à l’insuline n’ont toutefois été observées.5
-
1999
Le Dr James Shapiro est le pionnier du Protocole d’Edmonton,lequel utilise davantage d’îlots pancréatiques et une combinaison moins toxique de médicaments immunosuppresseurs que les greffes d’îlots pancréatiques précédentes.6 Cette procédure est saluée dans le monde entier comme une avancée extraordinaire et une validation de principe que la transplantation d’îlots pancréatiques pourrait possiblement fonctionner et justifie d’être étudiée davantage. Ce protocole est encore aujourd’hui une référence absolue.
-
2000
Les chercheurs au Centre de transplantation d’îlots pancréatiques de Percée DT1 (dont Doug Melton, Ph.D.) démontrent que l’ajout de certains facteurs de croissance pourrait orienter le développement de cellules souches humaines, ouvrant ainsi la voie au développement de cellules bêta à partir de cellules souches en laboratoire.7 Percée DT1 accorde une subvention de près de 1,4 million $ sur 10 ans à Dr Doug Melton, dans le but de fabriquer des cellules bêta à partir de cellules souches.
-
2001
Percée DT1 et les National Institutes of Health (NIH) cofondent le Immune Tolerance Network (ITN), un projet de 144 millions $ sur sept ans pour mener des essais cliniques visant à favoriser la tolérance immunitaire dans les contextes de transplantations, de maladies auto-immunes, d’asthme ou d’allergies. Le premier essai clinique majeur est une étude multicentrique visant à reproduire et à confirmer le succès préliminaire du Protocole d’Edmonton dans 10 sites en Amérique du Nord et en Europe.
-
2006
Novocell (qui deviendra plus tard ViaCyte) met au point un moyen de convertir les cellules souches en cellules productrices d’insuline.8 Les cellules ne sécrètent pas beaucoup d’insuline et ne le font pas en réponse au glucose, mais la recherche marque une première étape essentielle pour amener les cellules souches à devenir des cellules qui détectent le glucose dans le sang et produisent de l’insuline en conséquence.
-
2011
Percée DT1 soutient ViaCyte (anciennement Novocell) qui travaille à la mise au point d’une thérapie de remplacement des cellules bêta encapsulées qui combine des cellules bêta précurseurs fabriquées à partir de cellules souches qui avec le temps, se transforment en cellules pancréatiques matures productrices d’hormones, dont des cellules productrices d’insuline. Percée DT1 appuie vivement ViaCyte depuis ce temps.
-
2013
Percée DT1 lance le Consortium sur l’encapsulation, composé de chercheurs spécialisés en bioingénierie, biologie des cellules bêta, greffes pancréatiques et science des matériaux qui travailleront à l’élaboration et à l’intégration de nouveaux concepts d’ingénierie et de conceptions qui amélioreront l’encapsulation d’îlots pancréatiques. Percée DT1 continue aujourd’hui de réunir ce consortium, désormais connu sous le nom de Consortium sur le remplacement des cellules bêta.
-
2014
Des progrès considérables sont réalisés dans la fabrication de cellules bêta en laboratoire : Deux chercheurs financés par Percée DT1 (le Dr Timothy Kieffer, Université de Colombie-Britannique et le Dr Doug Melton, Université de Harvard) mettent au point une méthode pour convertir les cellules souches en cellules bêta productrices d’insuline.9, 10
—
Avec le soutien de Percée DT1, ViaCyte démarre son essai clinique sur la toute première thérapie de remplacement de cellules encapsulées issues de cellules souches, VC-01. L’essai clinique sera mené dans plusieurs sites auprès d’environ 60 personnes.
-
2015
Le Dr Doug Melton fonde Semma Therapeutics pour développer des cellules bêta à partir de cellules souches afin de mettre au point des thérapies curatives pour le DT1. En 2017, le Fonds DT1 de Percée DT1 fait un investissement catalyseur dans Semma pour permettre à l’entreprise de passer à la prochaine étape marquante.
-
2019
Vertex Pharmaceuticals fait l’acquisition de Semma Therapeutics pour près de 1 milliard $.
—
ViaCyte donne un compte rendu de sa thérapie VC-01 qui utilise des cellules issues de cellules souches de type îlots pancréatiques. Les données préliminaires montrent que les cellules pancréatiques précurseurs, les cellules PEC-01, implantées sous la peau et correctement greffées, ont la capacité de produire du peptide C circulant, un biomarqueur de l’insuline chez les personnes atteintes de DT1.
—
Sernova, une entreprise de médecine régénérative de stade clinique, a montré dans son essai clinique financé par Percée DT1 que son système Cell Pouch permet aux cellules d’îlots pancréatiques encapsulées provenant de donneurs décédés de produire et de sécréter de l’insuline chez les personnes atteintes de DT1.
-
2020
Des chercheurs financés par Percée DT1 s’associent à Advanced Regenerative Manufacturing Institute (ARMI) pour transformer le processus manuel de création de cellules bêta à partir de cellules souches en une procédure reproductible et automatisée afin qu’un nombre suffisant d’îlots pancréatiques de qualité contrôlée puisse être distribué à la communauté scientifique à des fins de recherche.
-
2021
Le Centre d’excellence de Percée DT1 à l’Université de Colombie-Britannique est inauguré à Vancouver. Axé sur les thérapies immunitaires et à base de cellules bêta, il s’agit du premier Centre d’excellence de Percée DT1 au Canada, lequel s’ajoute à un groupe de quatre autres centres aux États-Unis et en Australie. Le Centre d’excellence de Percée DT1 à l’Université de Colombie-Britannique accélérera la thérapie cellulaire par le biais de trois thèmes intégrés : (1) développer une nouvelle source de cellules bêta productrices d’insuline, (2) protéger les cellules bêta contre l’attaque du système immunitaire, et (3) cibler et surveiller le stress des cellules bêta.
—
Vertex lance un essai clinique sur le VX-880, lequel utilise des cellules bêta issues de cellules souches (dont le pionnier est le Dr Doug Melton de l’Université de Harvard) pour tenter de rétablir la capacité de l’organisme à produire de l’insuline, en combinaison avec un traitement immunosuppresseur pour protéger les cellules contre le rejet chez les personnes atteintes de DT1 qui subissent de graves épisodes d’hypoglycémie et pour celles dont l’hypoglycémie est parfois asymptomatique. Vertex annonce des données prometteuses au cours de l’année, selon lesquelles la première personne à recevoir le VX-880 a besoin de 91 % moins d’insuline après avoir reçu une perfusion de cellules entièrement différenciées avec seulement la moitié de la dose cible.
—
Une nouvelle première pour ViaCyte et CRISPR Therapeutics : L’édition génomique pour le DT1. D’ici la fin de l’année, elles amorceront un essai clinique sur le VCTX210, une thérapie de remplacement des cellules souches génétiquement modifiées pour cette maladie. La combinaison des capacités de pointe de ViaCyte dans le domaine des cellules souches, développées avec un soutien important de Percée DT1, et de la plateforme d’édition génomique prééminente de CRISPR Therapeutics, offre d’importantes possibilités pour le développement d’une thérapie de remplacement cellulaire qui ne nécessite pas d’immunosuppression, faisant ainsi progresser la mission de ViaCyte de trouver une guérison pour le diabète et la vision de Percée DT1 d’un monde sans DT1.
-
2022
Vertex Pharmaceuticals annonce l’acquisition de ViaCyte pour un montant de 320 millions $ US. Vertex et ViaCyte ont travaillé chacune de leur côté à la mise au point de thérapies de remplacement cellulaire pour les personnes atteintes de DT1. Cette fusion réunit deux des plus grandes entreprises travaillant à cette technologie pour le diabète et leur permettra de combiner leurs ressources, leurs technologies, leur propriété intellectuelle, et bien plus encore.
-
2023
Le Lantidra de CellTrans est la première thérapie cellulaire autorisée aux États-Unis pour usage chez les adultes qui ne parviennent pas à atteindre une moyenne dans les niveaux de glycémie en raison d’épisodes actuels et répétés d’hypoglycémie grave. Il s’agit d’une commercialisation de la transplantation de cellules de donneurs décédés utilisée en clinique au Canada depuis 2001.
—
Vertex fait rapport de résultats préliminaires sur le VX-880 : Les six patients sécrètent eux-mêmes de l’insuline, leurs taux HbA1c se sont améliorés, le temps passé dans la cible avec la surveillance du glucose en continu s’est amélioré et le besoin en insuline exogène est réduit ou éliminé (c’est-à-dire l’administration d’insuline externe au moyen d’un stylo injecteur, d’une pompe à insuline ou d’injections multiples sur une base quotidienne). L’absence d’événements hypoglycémiques graves a également été observée chez les patients qui ont été suivis au-delà de 90 jours.
—
Vertex amorce l’essai clinique sur le VX-264, lequel utilise les mêmes cellules que le VX-880, mais encapsulées, dans un dispositif immunoprotecteur. Ce dispositif permet d’éviter le recours à une immunosuppression.
—
Sernova donne un compte rendu sur son essai clinique (à Chicago, IL), annonçant que cinq patients ont reçu une pochette à 8 canaux 6 à 36 mois auparavant. Cinq patients ont été recrutés pour recevoir une pochette à 10 canaux qui augmente considérablement le nombre d’îlots pancréatiques (provenant d’une source de donneurs décédés) qui seront transplantés dans leur système Cell Pouch.
-
2024
Vertex présente les résultats préliminaires du VX-880 : Sur les 12 patients qui ont été dosés, presque tous (11 sur 12) ont vu une réduction ou une élimination de l’utilisation d’insuline exogène (par pompe ou injection). Tous les patients ont atteint un taux d’HbA1C inférieur à 7,0 % et un temps dans la cible supérieur à 70 % grâce à la surveillance continue du glucose et à la réduction ou à l’élimination de l’administration d’insuline. Aucun événement indésirable grave n’a été signalé. L’essai est en cours de recrutement pour 37 participants afin de progresser vers le développement pivot.
—
Sernova rapporte que, dans le cadre de son essai clinique en cours (cellules d’îlots de Langerhans de donneurs dans le système Cell Pouch de Sernova; Chicago, IL), les sept premiers patients ont atteint l’indépendance à l’insuline. Le recrutement est maintenant terminé pour la cohorte 2.
—
Vertex fait état d’une mise à jour sur l’essai VX-264 (UPWARD) : La partie A de l’essai est terminée. Il s’agit d’un petit nombre de participants qui ont reçu une « dose » partielle des cellules transplantées. Ces participants ont été échelonnés, ce qui signifie qu’il y a eu un délai avant que chaque participant supplémentaire ne commence l’essai pour s’assurer que le participant précédent tolérait bien la dose. Le VX-264 recrute et dose actuellement les participants de la partie B de l’essai (dose complète, c’est-à-dire qu’ils reçoivent le nombre total de cellules transplantées dans le cadre d’un départ échelonné).
—
En septembre 2024, des chercheurs chinois ont rapporté la première transplantation de cellules bêta créées à partir des propres cellules d’une personne (cellules autologues) chez une femme de vingt-cinq ans qui recevait déjà des immunosuppresseurs pour une greffe de foie.
—
Le 4 novembre 2024, Vertex Pharmaceuticals a annoncé une nouvelle importante : leur essai clinique de phase 1/2 pour la thérapie par cellules souches VX-880 sera converti en essai essentiel de phase 1/2/3, suite à l’examen réussi de la phase 2 par les organismes de réglementation. Un essai essentiel recueille les données nécessaires pour une soumission réglementaire (à Santé Canada ou d’autres organismes de réglementation comme la FDA) afin de commercialiser la thérapie. Cet essai viendra s’ajouter à l’essai international en cours (y compris 4 sites au Canada) et augmentera le nombre de participants de 37 à 50.
-
2025
Le 7 janvier 2025 (Suède), Sana Biotechnology a publié d’importantes données cliniques : la première personne atteinte de diabète de type 1 (DT1) ayant reçu des cellules des îlots pancréatiques provenant d’un donneur décédé, modifiés pour échapper au système immunitaire, produit de l’insuline sans immunosuppression après quatre semaines.
—
Le vendredi 28 mars 2025, Vertex a annoncé qu’elle mettait fin à l’un de ses essais de thérapie cellulaire pour le DT1. Le VX-264 est un essai portant sur des cellules d’îlots de Langerhans dérivées de cellules souches, transplantées dans un dispositif de macroencapsulation (comme des feuilles de thé dans un sachet), sans besoin d’immunosuppression. Malheureusement, bien que la première phase de l’essai ait été sûre et bien tolérée, elle n’a pas été efficace et ne sera donc pas poursuivie.
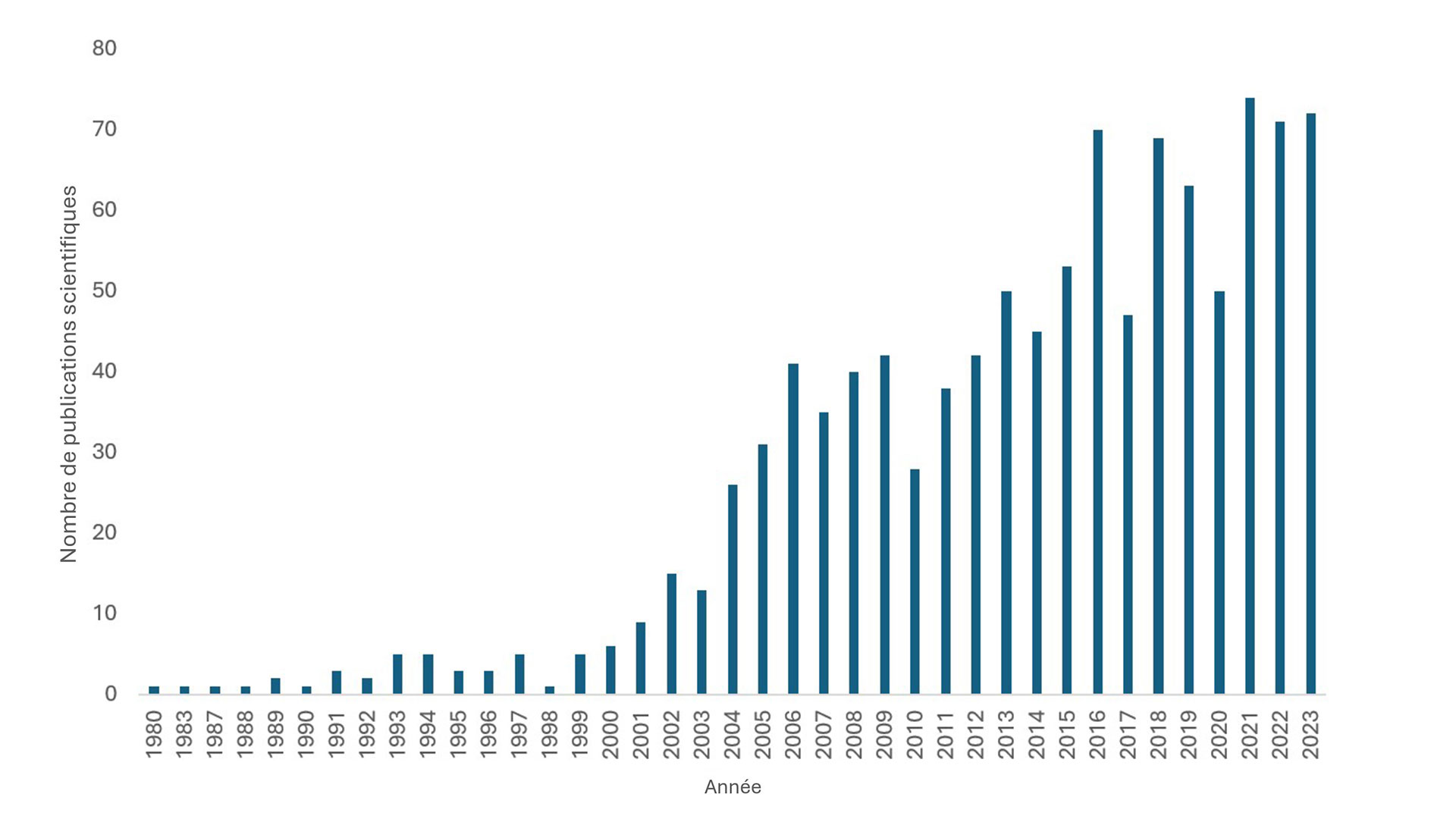
Aperçu du nombre croissant de publications scientifiques sur la thérapie cellulaire du diabète de type 1 depuis 1980
Références
- Najarian JS, Sutherland DE, Baumgartner D, Burke B, Rynasiewicz JJ, Matas AJ, Goetz FC. Total or near total pancreatectomy and islet autotransplantation for treatment of chronic pancreatitis. Ann Surg. 1980; 192 (4): 526-542. https://doi.org/10.1097/00000658-198010000-00011
- Shizuru JA, Gregory AK, Chao CT, Fathman CG. Islet allograft survival after a single course of treatment of recipient with antibody to L3T4. Science. 1987; 237 (4812): 278-280. https://doi.org/10.1126/science.2955518
- Scharp DW, Lacy PE, Santiago JV, McCullough CS, Weide LG, Falqui L, Marchetti P, Gingerich RL, Jaffe AS, Cryer PE, Anderson CB, Flye MW. Insulin independence after islet transplantation into type I diabetic patient. Diabetes. 1990 Apr; 39 (4): 515-8. https://doi.org/10.2337/diab.39.4.515 . PMID: 2108071.
- Tzakis AG, Ricordi C, Alejandro R, Zeng Y, Fung JJ, Todo S, Demetris AJ, Mintz DH, Starzl TE. Pancreatic islet transplantation after upper abdominal exenteration and liver replacement. Lancet. 1990; 336 (8712): 402-405. https://doi.org/10.1016/0140-6736(90)91946-8
- Groth CG, Korsgren O, Tibell A, Tollemar J, Möller E, Bolinder J, Ostman J, Reinholt FP, Hellerström C, Andersson A. Transplantation of porcine fetal pancreas to diabetic patients. Lancet. 1994 Nov 19; 344 (8934): 1402-4. https://doi.org/10.1016/s0140-6736(94)90570-3. PMID: 7968077.
- Shapiro AM, Lakey JR, Ryan EA, Korbutt GS, Toth E, Warnock GL, Kneteman NM, Rajotte RV. Islet transplantation in seven patients with type 1 diabetes mellitus using a glucocorticoid-free immunosuppressive regimen. N Engl J Med. 2000; 343 (4): 230-238. https://doi.org/10.1056/NEJM200007273430401
- Schuldiner M, Yanuka O, Itskovitz-Eldor J, Melton DA, Benvenisty N. Effects of eight growth factors on the differentiation of cells derived from human embryonic stem cells. Proc Natl Acad Sci U S A. 2000; 97 (21): 11307-11312. https://doi.org/10.1073/pnas.97.21.11307
- D’Amour KA, Bang AG, Eliazer S, Kelly OG, Agulnick AD, Smart NG, Moorman MA, Kroon E, Carpenter MK, Baetge EE. Production of pancreatic hormone-expressing endocrine cells from human embryonic stem cells. Nat Biotechnol. 2006 Nov; 24 (11): 1392-401. https://doi.org/10.1038/nbt1259
- Rezania A, Bruin JE, Arora P, Rubin A, Batushansky I, Asadi A, O’Dwyer S, Quiskamp N, Mojibian M, Albrecht T, Yang YH, Johnson JD, Kieffer TJ. Reversal of diabetes with insulin-producing cells derived in vitro from human pluripotent stem cells. Nat Biotechnol. 2014 Nov; 32 (11): 1121-33. https://doi.org/10.1038/nbt.3033
- Pagliuca FW, Millman JR, Gürtler M, Segel M, Van Dervort A, Ryu JH, Peterson QP, Greiner D, Melton DA. Generation of functional human pancreatic β cells in vitro. Cell. 2014 Oct 9; 159 (2): 428-39. https://doi.org/10.1016/j.cell.2014.09.040